CỘNG HƯỞNG TỪ PHỔ TRONG PHÂN ĐỘ U TẾ BÀO THẦN KINH ĐỆM VÙNG THÂN NÃO
BSNT Lê Phước Tấn Phát, Ths Trần Đức Hoàng, BSCKII Nguyễn Thanh Minh.
1.ĐẶT VẤN ĐỀ:
Với U tế bào thần kinh đệm, phân độ mô học đóng một vai trò quan trọng trong việc lập kế hoạch điều trị và có liên quan đáng kể đến tiên lượng sống thêm của bệnh nhân.
Để phân độ mô học thì giải phẫu bệnh chính là tiêu chuẩn vàng
Thân não là một khu vực của não giúp kết nối các hoạt động cao cấp về thể chất và chức năng của não với phần còn lại của cơ thể, có nhiều nhân xám là trung tâm hô hấp, trung tâm vận mạch,… Việc can thiệp vào khu vực này có thể để lại các di chứng vĩnh viễn, thậm chí là tử vong. Vì thế việc thực hiện sinh thiết hoặc phẫu thuật tại vị trí này vẫn còn là thách thức [3], [4].
Cùng với sự phát triển của y học hiện đại, sự ra đời của các kỹ thuật MRI nâng cao như cộng hưởng từ phổ (MRS), Cộng hưởng từ khuếch tán (MRI diffusion), Cộng hưởng từ tưới máu (MRI perfusion) đã mang lại nhiều đóng góp to lớn trong việc chấn đoán và phân loại các U thần kinh đệm ở thân não.
2.TỔNG QUAN
2.1 U tế bào thần kinh đệm thân não
U tế bào thần kinh đệm thân não: (Brainstem gliomas- BSG) là một u xuất phát từ các tế bào thần kinh đệm ở thân não.
– Chủ yếu gặp ở trẻ em, chiếm 10-20% trong số các u não gặp ở trẻ em [5]
– Thường được chẩn đoán trong độ tuổi 7-9 [5]
– Người lớn, chiếm 1-2% trong các loại u não[6]
– Nam/nữ = 1:1
U có thể nằm bất kỳ vị trí nào của thân não: Trung não, cầu não, hành não hoặc cũng có thể u lớn chiếm 2/3 hoặc toàn bộ các phần của thân não.
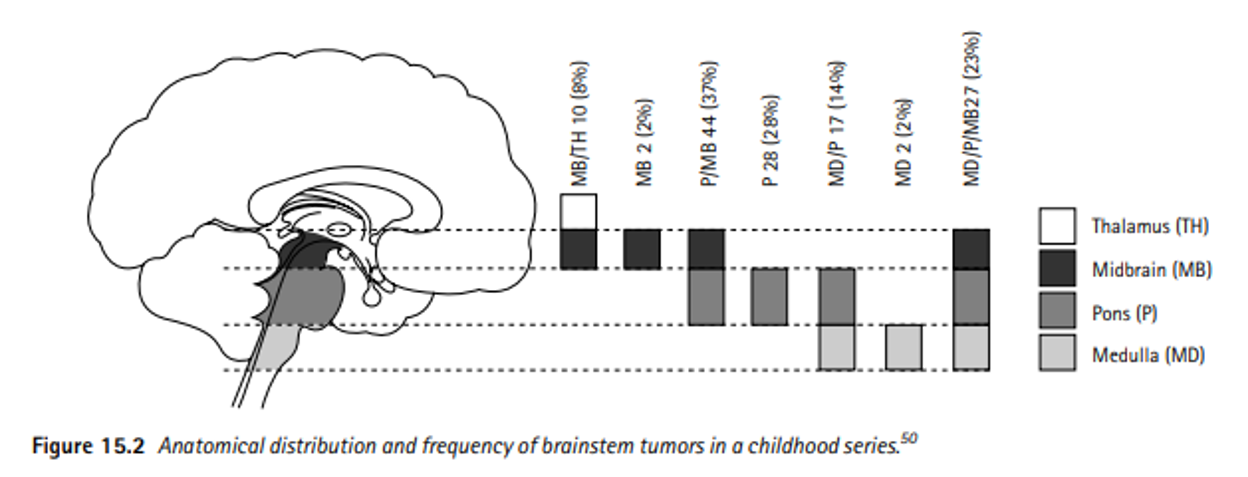
Hình 1: Sự phân bố và tần suất xuất hiện của u vùng thân não ở trẻ em[5]
Theo WHO 2021, U tế bào thần kinh đệm được chưa làm 4 độ: I, II, III và IV. Trong đó I, II được xếp vào nhóm u grade thấp; III, IV thuộc nhóm grade cao, với tiên lượng và chiến lược điều trị khác nhau. Các u tế bào thần kinh đệm grade thấp có thời gian sống lâu hơn nhóm grade cao[2].
2.2 Cộng hưởng từ phổ – MRS
MRS – Cộng hưởng từ phổ là kỹ thuật không xâm lấn cho phép đánh giá các chất chuyển hóa trong mô, cung cấp các thông tin về thành phần cấu tạo của mô đó.
Nguyên lý dựa vào hiện tương dịch chuyển hóa học(Chemical shift)
Trong MRS, tetramethysilane(TMS)-Si(CH3)4 được sử dụng làm phân tử chuẩn, tín hiệu của nó được quy đinh ở vị trí 0 ppm, các tín hiệu phần tử khác được sắp xếp dọc theo trục X tùy thuộc vào sự dịch chuyển hóa học của phân tử đó.
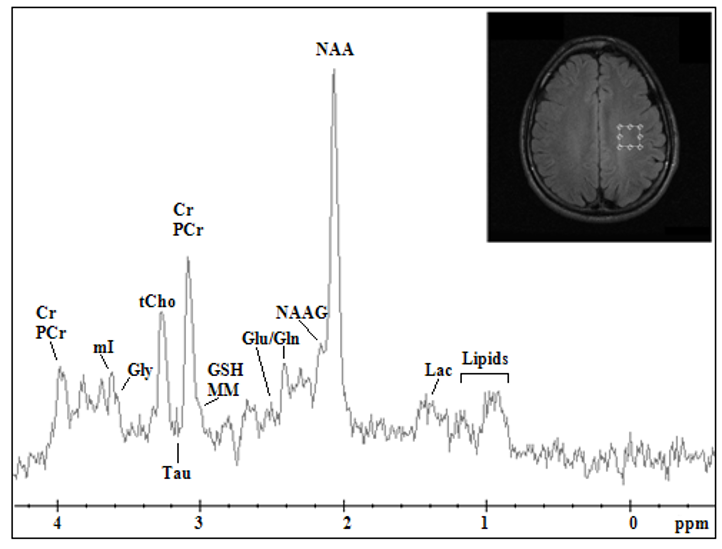
Hình 2: Biểu đồ phổ các chất trong MRS
Các chất trong cộng hưởng từ phổ được ứng dụng trong u tế bào thần kinh đệm thân não:
| 1 | NAA (Aspartate N-acetyl) | • Đạt đỉnh cộng hưởng tại 2.0 ppm
• Marker của neuron • Được sản xuất ở ty thể của tế bào nhân thần kinh. Sự hiện diện của nó là điều kiện bình thường thể hiện tính toàn vẹn của tế bào thần kinh và sợi trục • Giảm mức độ NAA có tổn thương các mô tế bào thần kinh |
| 2 | Creatine/phosphacreatine | • Đạt đỉnh cộng hưởng tại 3.0 ppm
• Marker của chuyển hóa năng lượng của não. Tương đối ổn đinh, và thường được dùng để so sánh • Tăng trong các khối u do tăng hoạt động trao đổi chất, đặc biết là trong u thần kinh đệm bậc cao. • Giảm hoặc mất, kết hợp với các chất chuyển hóa khác, gợi ý có hiện tượng hoại tử |
| 3 | Choline | • Đạt đỉnh cộng hưởng tại 3.2ppm
• Marker của việc kiến tạo/phá hủy của màng tế bào • Tăng trong tăng trong tăng phân chia tế bào • U ác tính càng cao – tăng cholin càng cao • Giảm trong trường hợp phá hủy: Nhồi máu, abscess… |
| 4 | Lipid | • Được đánh dấu bằng một loạt đỉnh cộng hưởng giữa 0.9 – 1.5ppm
• Lipid tăng là dấu hiệu của hoại tử: Hoại tử sau xạ, hoại tử u • Nhu mô não bình thường đỉnh lipids rất thấp. |
| 5 | Lactac | • Đỉnh cộng hưởng kép tại 1.33 ppm.
• Đỉnh dương TE ngắn, âm ở TE 135-144ms • Thường Lactate không nhìn thấy do nồng độ thấp hơn giới hạn phát hiện của MRS • Tăng lactat là dấu hiệu của chuyển hóa kỵ khí: Nhồi máu não, u não độ ác tính cao |
Bảng 1: Phân tích phổ các chất chính trong u tế bào thần kinh đệm ở vùng thân não
Phân tích phổ các chất:
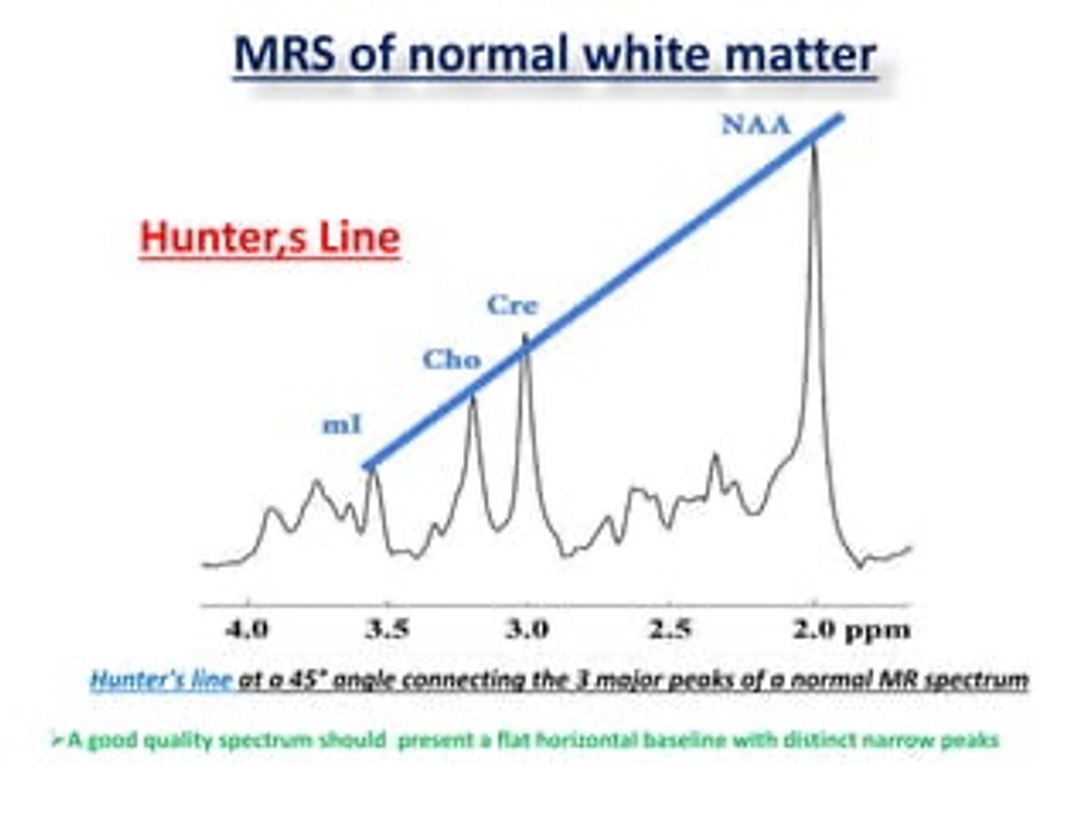
Hình 3: Hình ảnh phổ các chất bình thường
- Dựa vào tính chất đối lập giữa NAA với Cho, và tính hằng định của Cr
- Ngoài sự tăng giảm phổ các chất, người ta đã đưa ra các tỷ lệ, để giúp ích trong việc phận độ BSG: Cho/NAA, Cho/Cr và NAA/Cr
- Nhiều nghiên cứu cho răng việc sử dụng tỉ lệ Cho/NAA, Cho/Cr và NAA/Cr hữu ích trong việc phần biệt U bậc cao vào thấp. Khi tỉ lệ, Cho/NAA, Cho/Cr càng cao, NAA/Cr càng thấp dự báo cho một U thế bào thần kinh đệm với độ ác tính cao[7], [8]. Hiện nay ở các nước đang phát triển, nơi cơ sở vật chất còn nhiều hạn chế, MRS được xem như là một phương tiện chẩn đoán thường quy cho các u tế bào thần kinh đệm ở vùng thân não[1].

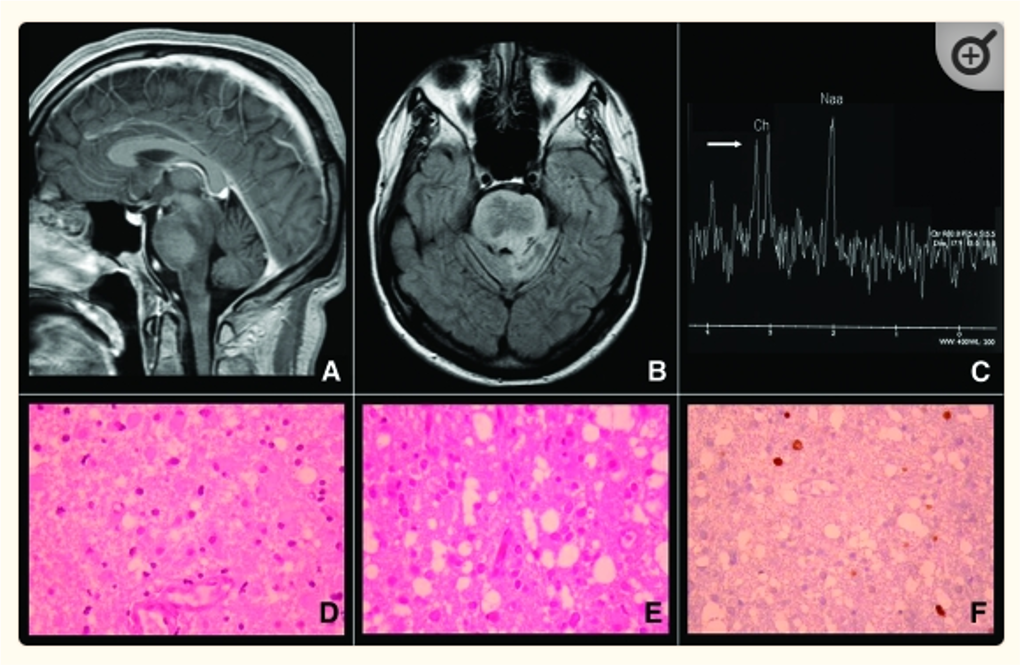
Hình 4: U vùng thân nào: Oligoastrocytoma-grade II
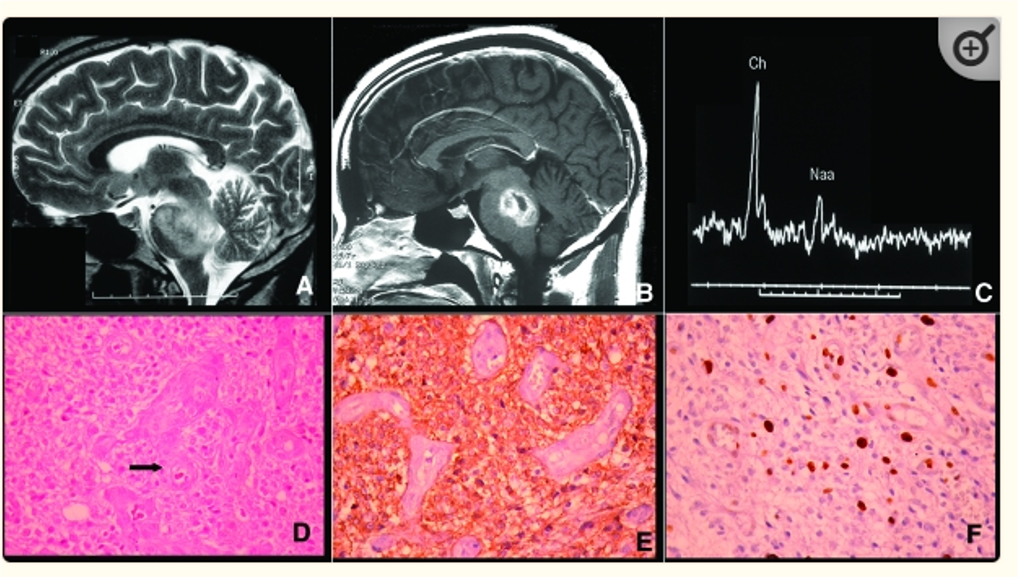
Hình 5: U vùng cầu não: Anaplastic oligodendroglioma Grade II
3.TỔNG KẾT
U tế bào thần kinh đệm vùng thân não là bệnh lý hiểm gặp, tiên lượng xấu.
Việc phân bậc u có vai trò quan trọng trong định hướng điều trị và tiên lượng bệnh.
Giải phẫu bệnh là tiêu chẩn vàng trong phân bậc U tế bào thần kinh đệm.
Phân tích cộng hưởng từ phổ cần được đặt trong sự phân tích một cách hệ thống từ lầm sàng , cận lâm sàng, cộng hưởng từ khuếch tán, tái máu … để nâng cao tỉ lệ chẩn đoán và phân bậc đúng BSG.
TÀI LIỆU THAM KHẢO:
- Abu O., Rahman A., Khan R. et al (2020), “Magnetic Resonance Spectroscopy for Prediction of Grades of Diffusely Infiltrating Intracranial Astrocytomas”, J Neurosci Rural Pract. 11(4), pp. 581-584.
- Claus E. B., Walsh K. M., Wiencke J. K. et al (2015), “Survival and low-grade glioma: the emergence of genetic information”, Neurosurg Focus. 38(1), pp. E6.
- Cheng G., Yu X., Zhao H. et al (2020), “Complications of stereotactic biopsy of lesions in the sellar region, pineal gland, and brainstem: A retrospective, single-center study”, Medicine (Baltimore). 99(8), pp. e18572.
- He L., He D., Qi Y. et al (2021), “Stereotactic Biopsy for Brainstem Lesions: A Meta-analysis with Noncomparative Binary Data”, Cancer Control. 28, pp. 10732748211059858.
- Recinos P. F., Sciubba, D. M., & Jallo, G. I (2007), “Brainstem tumors: where are we today?”, Pediatric neurosurgery. 17(3), pp. 192-201.
- Reyes-Botero G., Mokhtari K., Martin-Duverneuil N. et al (2012), “Adult brainstem gliomas”, Oncologist. 17(3), pp. 388-97.
- Tran D., Nguyen D. H., Nguyen H. K. et al (2022), “Diagnostic performance of MRI perfusion and spectroscopy for brainstem glioma grading”, Eur Rev Med Pharmacol Sci. 26(21), pp. 7938-7948.
- Yang D., Korogi Y., Sugahara T. et al (2002), “Cerebral gliomas: prospective comparison of multivoxel 2D chemical-shift imaging proton MR spectroscopy, echoplanar perfusion and diffusion-weighted MRI”, Neuroradiology. 44(8), pp. 656-66.
